
原代细胞培养相关介绍
一、应用简介
原代细胞指来源于胚胎、组织器官或外周血,经特异性分离方法制备获得的初始培养细胞。这类细胞通过原代分离获得,具备与体内细胞相近的生物学特性,是研究生物体相关生命活动的理想实验材料。
二、原理介绍
原代细胞分离的核心原理是:从人、小鼠等特定模式动物的机体中获取细胞,经胰酶、螯合剂(常用EDTA)处理分散为单细胞后,置于适宜培养基中培养,使细胞实现存活、生长与增殖。原代培养特指直接从机体获取细胞、组织或器官后立即开展的培养过程,严格意义上仅涵盖成功传代前的培养阶段——此阶段细胞保留原有基本特性,若为正常细胞则仍维持二倍体核型。实际应用中,通常将第一代至第十代以内的培养细胞统一称为原代细胞培养。目前最常用的原代培养方式主要分为组织块培养和分散细胞培养两类。
三、实验方法
(一)悬浮细胞的分离方法
若组织材料来源于血液、羊水、胸水或腹水等悬浮体系,可采用低速离心法分离。离心过程中,因不同细胞比重存在差异,会在分层液中形成不同层次,据此可精准收获目标细胞。
(二)实体组织材料的分离方法
实体组织材料中细胞间结合紧密,需通过特定方法使细胞充分分散形成细胞悬液,常用方法包括机械分散法(物理裂解)和消化分离法两类:
1. 机械分散法:操作简便、快速,但对组织的机械损伤较大,且细胞分散效果欠佳,适用于处理纤维成分含量低的软组织;
2. 消化分离法:先将组织剪切成细小团块(或糊状),借助酶的生化作用或非酶化学作用松动细胞间桥连结构,使组织团块膨松至絮状;随后结合机械方法(如吸管吹打、电磁搅拌或摇珠瓶振荡)进一步分散,最终制备成含少量细胞群团和大量单细胞的细胞悬液。该方法获得的细胞接种培养后,更易实现贴壁生长。
(三)小鼠肝细胞原代培养
流程图:
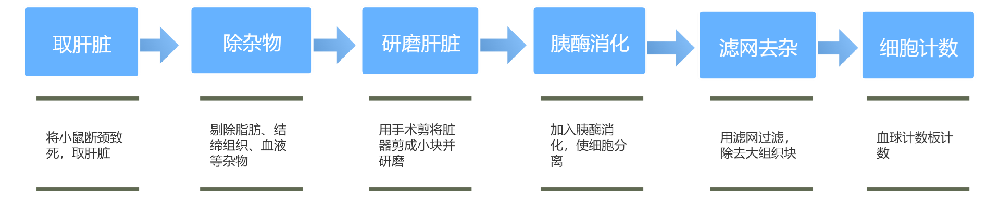
四、关键操作注意事项
1. 材料选择:优先选取繁殖能力较强的组织,如胚胎、幼小生物体组织或肿瘤组织等,以提升培养成功率;也可选用新生乳鼠作为培养材料,但其原代培养污染概率更高,细胞存活率低于胚胎细胞培养。
2. 无菌控制:全程严格遵循无菌操作规范,操作要求高于外科手术;若使用新生乳鼠,需将其浸入75%乙醇中2~3min以充分消毒皮肤,操作过程需格外谨慎,避免细菌污染。
3. 取材操作:整体流程需迅速高效,尤其孕鼠浸泡乙醇消毒时间需控制在1min左右,避免时长过长损伤胚胎细胞活性;组织离体后应尽快置于预冷保存液中,防止细胞因缺氧或温度不适受损。
4. 消化操作:采用消化法时,胰酶温度需低于37℃,浓度控制为常规培养细胞消化浓度的一半。由于原代细胞消化过程至少需20min,远长于常规培养细胞的1~10min,先消化下来的细胞会在胰酶液中持续受作用10min以上,因此需严格控制胰酶作用强度,避免细胞受损影响存活。
5. 组织块培养操作:若采用组织块法培养,需待组织块略干燥并黏附于瓶壁后,再使其与培养液接触,避免组织块漂浮。若组织块未成功黏壁,细胞难以生长;即便生长,也因未贴附瓶壁无法观察和收集。
6. 洗涤处理:原代培养操作中,可使用未添加血清的DMEM或PBS洗涤子宫、胚胎或组织块等,以去除杂质。
五、全程核心把控要点
原代细胞分离与培养对实验条件要求严苛,各环节需精细把控:
1. 取材阶段:除严格无菌操作外,所用器械、培养液需提前完成灭菌处理,从源头上降低污染风险。
2. 分离阶段:根据组织特性选择适配的分离方法;采用酶解法时,需精确控制胰蛋白酶、胶原酶等消化酶的浓度与作用时间,防止过度消化破坏细胞结构;采用机械分离时,操作需轻柔,避免细胞因机械力受损。分离后的细胞需及时清洗,去除残留酶液和组织碎片,并通过合适的筛选方法纯化目标细胞。
3. 培养阶段:为原代细胞匹配专用培养基,并添加适量血清或生长因子;定期更换培养液,维持稳定的营养供应与酸碱平衡。培养环境需保持恒定的温度、湿度与气体浓度,避免频繁移动培养皿干扰细胞贴壁与生长。同时,需密切观察细胞生长状态,及时处理污染、老化等问题,保障原代细胞培养的成功率与细胞活性。


