
细胞增殖检测技术应用简介
细胞增殖是生物体的核心生命特征之一,细胞主要通过分裂的方式实现增殖过程。对于单细胞生物而言,细胞分裂是产生新个体的繁殖途径;而多细胞生物则依靠细胞分裂生成新细胞,以此补充体内衰老、损伤或死亡的细胞,维持机体正常的生长发育与稳态平衡。
细胞增殖常用检测方法
MTT、CCK-8、BrdU、EdU 等技术是目前广泛应用的细胞增殖检测手段,这些方法从细胞代谢活性和DNA 合成水平两个核心维度,精准反映细胞的增殖状态。其中,MTT 与 CCK-8 的检测原理一致:活细胞线粒体中的脱氢酶可将检测试剂还原为甲瓒,死细胞因代谢活动停止则不具备该功能。BrdU 和 EdU 的检测则基于 DNA 合成的特异性:两种物质可在细胞增殖的 S 期(DNA 复制期)替代胸腺嘧啶(T)渗入新合成的 DNA 链,后续通过与荧光染料的特异性结合反应,即可定性定量检测细胞的 DNA 复制活性。
MTT 技术原理
活细胞线粒体中含有的琥珀酸脱氢酶,能够催化外源性 MTT 还原为水不溶性的蓝紫色结晶甲瓒(Formazan),并沉积于细胞内;死细胞因线粒体功能丧失,无法完成这一还原过程。实验中,可采用二甲基亚砜(DMSO)溶解细胞内的甲瓒结晶,随后使用酶标仪在 490nm 波长下测定其吸光度值(OD 值)。在一定的细胞数量范围内,甲瓒结晶的生成量与活细胞数量呈正相关关系。研究人员可根据测得的 OD 值判断活细胞数量:OD 值越高,表明细胞活性越强;若应用于药物毒性检测,则 OD 值越高意味着药物对细胞的毒性越小。
实验方法
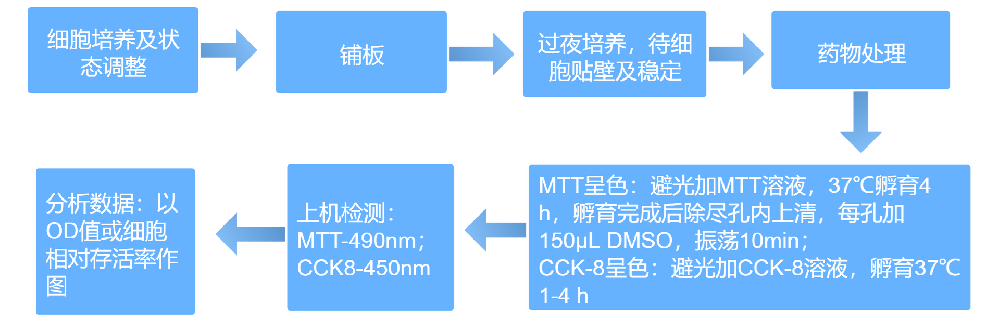
细胞增殖实验常见问题及注意事项
一、 实验操作常见问题
细胞铺板不规范:铺板密度设置不合理,细胞分布均匀度差,易导致组内数据偏差过大。
实验分组设计不严谨:分组逻辑不清晰、对照设置缺失或不合理,无法有效支撑实验结论。
检测时间点选择不当:未结合细胞生长周期规律设置时间点,难以精准捕捉细胞增殖的关键变化阶段。
试剂加样操作不规范:MTT 或 CCK-8 试剂添加环节的操作标准不明确,易引发加样量误差或反应条件不一致。
干扰因素控制不足:高浓度血清或带颜色的药物会干扰检测孔吸光度值的测定,造成结果假性偏差。
边缘效应影响:培养板边缘孔水分挥发速度较快,易导致孔内药物浓度浓缩,影响细胞生长状态与实验结果。
二、 实验全流程关键注意事项
(一) 样本处理与复苏
样本处理的规范性直接影响细胞活性与实验准确性。原代细胞取材需严格遵循无菌操作规范,取材后需迅速转移至适配培养基中,减少细胞暴露时间,避免细胞受损;传代细胞复苏时,需采用快速解冻法,降低冰晶对细胞造成的机械损伤,复苏后要及时更换新鲜培养基,彻底去除冻存保护剂,防止其对细胞产生毒性作用。
(二) 细胞培养与维护
需根据细胞的生物学特性选择专属适配培养基,并定期更换培养基,保证细胞获得充足营养供应,同时避免代谢废物过度积累。严格控制细胞接种密度,密度过高易引发接触抑制,密度过低则会影响细胞正常生长增殖。全程遵守无菌操作要求,实验耗材与试剂使用前需彻底灭菌,杜绝微生物污染。精准把控胰酶消化时间,避免消化过度导致细胞裂解,或消化不充分造成细胞难以分离。
(三) 细胞冻存要点
冻存细胞时需采用逐步降温的操作流程,配置冻存液时需添加合适的保护剂,以此维持细胞在低温环境下的活性,为后续实验储备高质量的细胞样本。


