
慢病毒包装、滴度检测及细胞感染技术原理
一、慢病毒包装
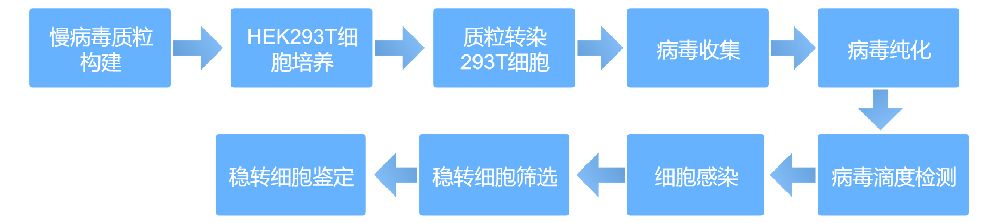
采用三质粒慢病毒包装系统:干扰慢病毒系统选用 pLKO.1-EGFP、psPAX2、pMD2.G 质粒组合,过表达慢病毒系统选用 pLVX-AcGFP、psPAX2、pMD2.G 质粒组合。将对应质粒充分混匀后,通过磷酸钙转染法导入 HEK293T 细胞,继续培养 48h 后收集细胞培养上清液。经纯化处理后,取部分样品进行病毒滴度检测,剩余病毒液置于 -80℃冰箱中冻存备用。
二、滴度检测
将纯化后的病毒颗粒进行梯度稀释,随后分别感染 293T 细胞。感染后培养 72h,利用荧光显微镜观察并记录细胞的荧光表达情况,依据阳性荧光细胞数量及荧光强度计算病毒滴度。
三、细胞感染
病毒感染前 1 天对目标细胞进行计数,按每孔约 10000 个细胞的密度接种至 12 孔板,培养过夜。次日采用无血清培养基稀释病毒液,加入 12 孔板中进行细胞感染;病毒用量根据目标细胞推荐的感染复数(MOI)确定,若无推荐 MOI 值,则设置 1、5、10、50、100 五个梯度进行感染优化。感染 6h 后,移除含病毒的培养基,更换为完全培养基继续培养 48h,通过荧光显微镜观察细胞荧光强度以验证感染效果。同时加入嘌呤霉素(puromycin)进行稳定细胞株筛选,筛选周期约 2 周。筛选获得稳定细胞株后,采用定量 PCR 技术检测目的基因的转录水平,通过 Western blot 技术检测目的蛋白的表达水平,以确认目的基因的稳定表达。
实验方法
二、关键技术要点与注意事项
(一)MOI相关要点
MOI(multiplicity of infection,感染复数)指感染时病毒与细胞的数量比值。多数细胞的推荐MOI可通过查阅文献获取,但受实验室环境、病毒批次及测算方法差异影响,不同来源的MOI参考价值有限。因此,建议针对自行包装的慢病毒,单独开展预实验检测适配目标细胞的MOI值,以保障感染效果。
(二)单克隆稳定细胞株筛选要点
为获得最佳质量的单克隆稳定细胞株,可通过增大筛选样本总量的方式,提升筛选到高纯度、高稳定性阳性克隆的概率。
(三)全流程操作关键注意事项
慢病毒介导的稳定细胞株构建流程复杂,各环节操作的严谨性直接决定实验成功率,核心注意事项如下:
1. 载体构建阶段:需反复校对目的基因序列,避免出现移码突变;载体与目的片段连接后,需通过菌落PCR、测序等方式验证插入方向及序列完整性,排除假阳性克隆。
2. 病毒包装阶段:确保293T等包装细胞处于对数生长期,以保障高转染效率;精准优化转染试剂与质粒的比例,减少细胞毒性;收集病毒上清时,需经多次低速离心去除细胞碎片,后续及时进行病毒浓缩与纯化,避免病毒滴度随时间下降。
3. 细胞感染阶段:通过预实验摸索最佳MOI值,防止因感染过度导致细胞死亡或感染不足影响实验效率;实验中需设置未感染细胞(阴性对照)、空载病毒感染细胞(阳性对照),排除背景干扰;感染后经嘌呤霉素筛选获得稳定细胞株,需定期检测目的基因表达水平,避免出现基因沉默或丢失,保障细胞株质量稳定可靠。


