
细胞分选技术(MACS与流式分选)详解
一、应用简介
免疫磁珠细胞分选技术(MACS)是一种高效、简便的免疫细胞及其他细胞分离纯化方法。其核心原理为:已包被一抗的磁珠可与细胞表面对应分子特异性结合;或已包被二抗(羊抗小鼠/羊抗大鼠)的磁珠,可与预先结合于细胞表面分子的一抗结合。结合磁珠的细胞会吸附于分离柱或试管上,进而实现阳性细胞或阴性细胞的分离。
二、技术原理
(一)流式分选原理
将经荧光染色或标记的单细胞悬液加入样品管后,通过高压驱动进入流动室。流动室内充盈鞘液,在鞘液的包裹与推动作用下,细胞被排列成单列,以稳定速度从流动室喷口喷出。喷口处配备超高频压电晶体,通电后产生振动,使喷出的液流断裂为均匀液滴,待测细胞均匀分散于液滴中。随后对液滴施加正负不同的电荷,当带电液流经过高压偏转板时,会在电场作用下向不同方向偏转,落入对应收集容器;未充电的液滴则落入中间废液容器,最终完成细胞分离。
(二)磁珠分选原理
免疫磁珠细胞分选法的核心是利用超顺磁性MACS微型磁珠对目标细胞进行特异性标记。标记完成后,将细胞悬液通过置于强稳定磁场中的分选柱,分选柱内的基质可形成高梯度磁场。被磁性标记的细胞会滞留于柱内,未标记细胞则顺利流出;当分选柱移出磁场后,滞留的磁性标记细胞可被洗脱,从而同时获得标记(目标)和未标记(非目标)两种细胞组分。
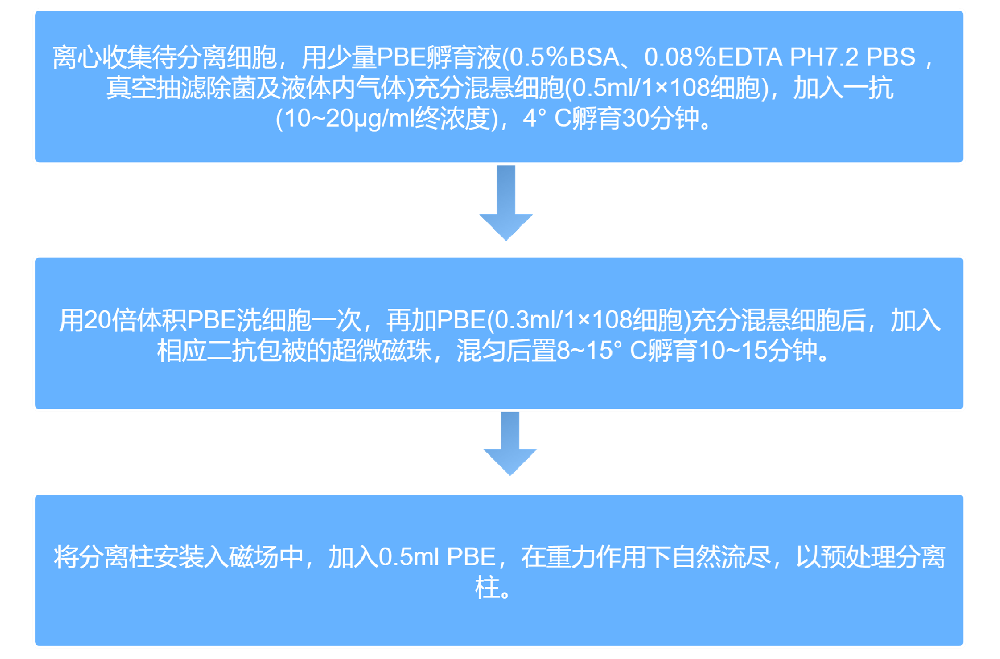
三、实验方法
本次实验采用免疫磁珠细胞分选(MACS)技术,具体实验流程如下:
(此处原文“流式细胞分选”表述突兀,结合上下文保留原文结构,后续可根据实际流程补充完整)
四、技术总结
(一)免疫磁珠分选(MACS)关键要点
1. 若分离的细胞用于后续培养,全过程需在超净台中操作,确保无菌环境。
2. 超微磁珠及配套微小磁场系统适用于少量细胞(10?-10?个)的分离,可满足多数实验研究需求;各厂商同时提供大磁珠及大磁场设备,可适配大量细胞分选。除分离柱外,也可选用试管等其他设备进行分选;根据实践经验,分离柱因提供更大的细胞-磁珠接触面积,在分选效果上更具优势。磁场可自行制备,普通磁铁即可搭建简易磁场,能提供足够的磁力驱动分选。
3. MACS系统的细胞分选纯度可达80%~99%,得率约60%~90%,分选效率接近或仅次于流式细胞仪(FACS)。与FACS相比,MACS设备简易、耗时极短,因此应用更为广泛。此外,MACS可作为FACS分选前的预分离步骤,减少FACS的操作时间;若需进一步提升纯度,可进行连续两次过柱分选,纯度通常可提升至95%~99%。
4. 在分离柱尾部连接限速针头,首次流出的细胞即为阴性选择细胞,其纯度通常低于阳性选择细胞。
5. 分离柱一般为一次性使用,重复使用会显著降低分选效率。
6. 分选后的细胞可采用荧光标记抗体(一抗或二抗)标记,再通过FACS鉴定纯度;也可先以荧光抗体直接标记细胞,再用二抗包被磁珠分选,分选后直接进行FACS分析,实现分选与纯度检测的同步完成。
7. 阳性选择完成后,若需基于第二种细胞表面标志进行二次分离,可使用剪切酶切除结合的磁珠与一抗,再开展下一轮分选;若需进行细胞功能分析,可将阳性选择细胞培养12~24小时,待结合的磁珠自然脱落後,再用于后续实验研究。
(二)流式细胞分选关键要点
流式细胞分选对实验环境及操作规范性要求极高,各环节需严格把控:
1. 分选前准备:需将样本制备为单细胞悬液,避免细胞团块堵塞管路;组织样本消化时,需严格控制酶浓度与作用时间,防止细胞损伤。样本需经滤网过滤去除杂质,并将细胞浓度调节至1×10?-1×10?/mL,浓度过高易导致分选误差,过低则降低分选效率。
2. 仪器调试:需根据细胞大小、荧光强度优化激光功率、电压及分选参数,并采用标准微球校准液流稳定性,确保仪器处于最佳工作状态。分选过程中需保持鞘液无菌及压力稳定,避免液流波动造成分选偏差;同时提前准备好收集管,管内预装适宜的缓冲液或培养基,保障细胞活性。
3. 分选后处理:需及时检测细胞活力与纯度,评估分选效果;若细胞用于后续培养,需更换新鲜培养基,避免残留分选液抑制细胞生长。此外,全程需做好生物安全防护,若分选含病原体或特殊样本,实验后需对仪器进行严格消毒,防止污染扩散。


