
Co-IP检测技术介绍
一、应用简介
Co-IP(免疫共沉淀)主要用于检测蛋白质与蛋白质之间的相互作用,是IP(免疫沉淀)实验的延伸技术。该技术依托IP反应的核心潜力,可在样品溶液中特异性捕获并纯化主要目标物质(如抗原),以及通过天然相互作用与靶标结合的其他大分子。此外,Co-IP还可用于明确不同条件下蛋白质间的相互作用情况,为相关研究提供关键依据。
二、技术原理
免疫共沉淀的核心原理是利用抗原与抗体的特异性结合特性,以及细菌Protein G或Protein A可特异性结合免疫球蛋白Fc片段的特性。具体流程为:在细胞裂解液中加入针对目标兴趣蛋白的抗体,孵育后再加入结合于磁珠的Protein G或Protein A;若细胞内存在与兴趣蛋白结合的目的蛋白,会形成“目的蛋白—兴趣蛋白—抗兴趣蛋白抗体—Protein G/Protein A”的蛋白复合物;最终通过免疫印迹实验检测复合物中的目的蛋白,从而验证二者的相互作用。
三、实验方法
1. Co-IP检测核心流程
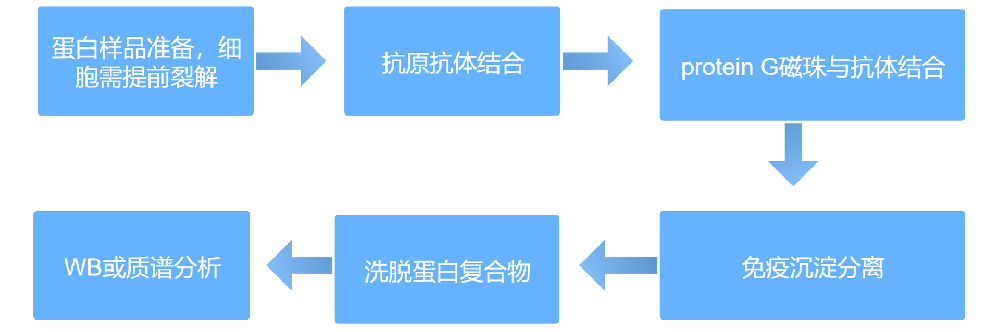
核心环节:Co-IP检测(含样品制备、细胞裂解、抗体孵育、Protein G/Protein A磁珠结合、复合物洗涤、免疫印迹检测等关键步骤)
四、技术总结
1. 实验样品制备:样品制备是实验成功的关键前提。根据研究目的,检测样品可分为组织样品和细胞样品,不同类型样品的制备流程存在差异,且目的蛋白表达量也有较大差别,因此必须精准选择适配的样品类型及对应的制备方法。
2. 抗体选择:需根据研究目的挑选适配的蛋白特异性抗体,这是实验成功的核心要素。Co-IP实验所用抗体需针对目的蛋白,最理想的抗体应能识别兴趣蛋白的特定表位,且该表位不会被其他蛋白质的相互作用所掩盖,其要求远高于普通WB抗体;同时,应优先选择特异性和灵敏性较高的抗体,以保障实验背景干净、IP效果良好。
3. 细胞裂解条件:需采用温和的裂解条件,避免破坏细胞内天然存在的蛋白质-蛋白质相互作用,常用非离子变性剂(如NP-40或Triton-X-100)。不同细胞的最优裂解条件存在差异,需通过实验经验总结确定。
4. 裂解液成分控制:禁止使用高浓度变性剂(如0.2%SDS),且细胞裂解液中需添加各类酶抑制剂,防止目的蛋白降解。
5. 对照抗体使用:需合理设置对照抗体,若使用小鼠单克隆抗体,可选用正常小鼠IgG或其他类型单抗作为对照;若使用兔多克隆抗体,可选用正常兔IgG作为对照。
6. 非特异性污染规避:需确保共沉淀的蛋白是由所加抗体特异性沉淀获得,而非外源非特异性蛋白,使用单克隆抗体有助于降低污染风险。
7. 抗体特异性验证:需验证抗体的特异性,即在不表达目标抗原的细胞裂解物中添加该抗体后,不会引发非特异性共沉淀。
8. 相互作用真实性确认:需明确蛋白质间的相互作用是在细胞内天然发生的,而非细胞裂解后人工形成的,这需要通过蛋白质定位实验进一步验证。
五、关键操作规范
Co-IP检测的准确性依赖全流程精细操作,核心规范补充如下:样品制备需保持目的蛋白的天然构象,避免因处理不当破坏蛋白间相互作用;抗体孵育过程需严格控制温度和时间,保障抗体与兴趣蛋白的特异性结合效率;磁珠结合及后续洗涤步骤需轻柔操作,既要彻底去除杂蛋白,又要避免复合物丢失;免疫印迹检测环节需规范操作,确保检测结果的可靠性;实验全程需设置多重对照,包括阴性对照、阳性对照等,全面排除非特异性干扰。


