
蛋白质免疫印迹(Western Blot, WB)技术介绍
一、应用简介
蛋白质免疫印迹法(Western Blot,简称WB),其核心流程为:通过SDS-PAGE凝胶电泳分离不同分子量的蛋白质,随后将目标蛋白转移至载体(如PVDF膜)上;利用抗原与抗体的特异性结合作用,使特异性一抗结合目标蛋白,再通过HRP标记的二抗结合一抗,最后加入ECL发光液显色,从而检测组织或细胞内特定一种或多种蛋白质的表达情况。
WB是蛋白质分析领域的常规核心技术,不仅可用于鉴定特定蛋白质,还能实现蛋白质的定性与半定量分析,同时可作为蛋白质-蛋白质、蛋白质-DNA、蛋白质-RNA相互作用研究的后续分析手段。目前,WB技术已广泛应用于蛋白水平表达研究、抗体活性检测、疾病早期诊断等多个研究领域。
二、技术原理
WB技术的核心原理基于电泳分离与抗原抗体特异性结合:首先通过SDS-PAGE凝胶电泳,将细胞或生物样品中的蛋白质按照分子量从大到小的规律分离;随后将经PAGE分离的蛋白质样品转移至固相载体(如硝酸纤维素薄膜或PVDF膜)上,固相载体以非共价键形式吸附蛋白质,且可保持电泳分离的多肽类型及其生物学活性不变;以固相载体上的蛋白质或多肽作为抗原,与对应的特异性一抗发生免疫反应,再与酶标记(目前主要为HRP标记)的二抗结合;最后通过底物显色或放射自显影检测特异性目的基因表达的蛋白成分(目前主流采用鲁米诺与二抗中HRP反应产生荧光,通过仪器或胶片显色)。该技术广泛应用于蛋白质水平表达的检测分析。
三、实验方法
1. WB检测核心流程
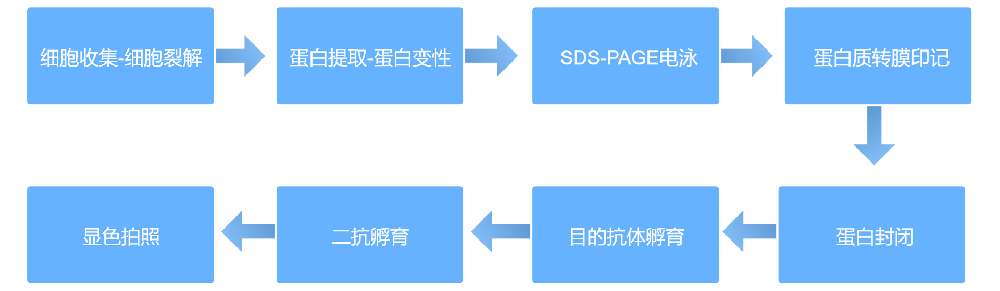
核心环节:WB检测(含样品制备、SDS-PAGE凝胶电泳、蛋白转膜、封闭、一抗孵育、二抗孵育、ECL显色、结果检测等关键步骤)
四、常见问题
1. WB技术有哪些优点?
灵敏度高,可达ng级,采用ECL显色法时灵敏度可提升至pg级;同时具备相对成本低廉、特异性强的优势。
2. 细胞提取液为何有的有沉淀,有的清亮?
提取液出现沉淀,可能是蛋白质变性不完全导致,可通过适当提高SDS浓度、延长样品煮沸时间(一般需96℃以上加热10-15min)解决;也可能是抗原浓度过高,此时需补充加入适量上样缓冲液。
3. 胶片背景过脏,如何解决?
解决方案:减少抗原上样量、降低一抗浓度;调整一抗孵育条件(优先选择4℃过夜孵育,该条件比37℃孵育1h更温和,可减少非特异性结合);提高封闭液浓度,增强封闭效果以降低非特异性背景。
4. 目标条带为空白但周围有背景,原因是什么?
核心原因:一抗浓度过高、二抗HRP催化活力过强,且显色底物处于反应临界点,短时间内周围底物被催化耗尽,形成空白条带,即“反亮现象”。解决方案:降低一抗与二抗浓度,或更换全新进口显色底物。
五、 电泳过程中常见现象及原因分析
1. 条带呈“︶”笑脸状:原因是凝胶冷却不均匀(中间冷却不充分)、电泳系统温度偏高,或电场强度过大(电泳电场大致呈U形,盲目加大电压赶时间易出现该现象)。
2. 条带呈“︵”皱眉状:多因实验装置问题导致,尤其可能是凝胶与玻璃挡板底部存在气泡,或凝胶两侧聚合不完全。
3. 条带拖尾:主要原因是样品溶解不充分,或蛋白质存在一定程度的降解。
4. 条带出现纵向纹理:源于样品中含有不溶性颗粒,可能是蛋白抽提过程存在操作问题。
5. 条带偏斜:因电极不平衡或加样位置偏斜导致,需确保电泳在水平平台上进行,且凝胶制备规范。
6. 条带两边扩散:由于加样量过多,样品弥散至加样孔周围,可通过减少上样量或使用5×上样缓冲液解决。
六、关键操作规范
WB检测的准确性依赖全流程精细操作,核心规范补充如下:样品制备需确保蛋白质充分变性且不降解,上样前需彻底混匀样品;凝胶制备需保证浓度均匀、无气泡,电泳过程严格控制电压与温度,避免影响分离效果;转膜时需根据蛋白分子量调整转膜时间与电流,确保蛋白高效转移至固相载体;封闭环节需选用适配的封闭液,保障封闭充分以降低非特异性结合;抗体孵育需严格控制浓度、温度与时间,孵育后充分洗涤去除未结合抗体;显色过程需精准把控时间,避免显色过度或不足;实验全程需设置阴性对照与阳性对照,确保结果的可靠性与重复性。


