
MCAO脑缺血模型相关说明
应用简介
MCAO是middle cerebral artery occlusion的缩写,中文译为大脑中动脉栓塞。需明确的是,大脑中动脉栓塞模型并非将线栓直接插入大脑中动脉,而是经颈内动脉入颅后插入大脑前动脉,借此阻断栓塞侧大脑前动脉的血供,并堵塞接受后交通动脉血供的颈内动脉颅内段。
缺血性脑损伤多见于中老年人,具有发病率、死亡率、致残率及复发率高的特点,是当前重点防治的疾病之一。大脑中动脉(MCA)是临床上脑缺血损伤的高发部位,因此大脑中动脉阻塞(MCAO)模型被广泛应用于局灶性脑缺血相关研究。采用血管内线栓阻断法制备大鼠MCAO模型,已得到脑血管病研究者的广泛认可与采用。目前实验室中,较常采用MCA阻断0min、90min及120min的短暂脑缺血-再灌注模型。
脑缺血模型
脑缺血模型主要通过实验动物(大鼠)模拟人类脑部血管血流减少及阻断的过程,为脑缺血的预防与治疗研究提供科学依据。适配的医学研究方向包括脑外科、神经内科等领域。
实验方法
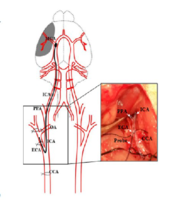
动物分组:选取健康SD雄性大鼠,体重250~300g,随机分为正常组、假手术组、模型组三组,每组9只。大鼠经腹腔麻醉后固定,分离右侧颈总动脉(CCA)、颈内动脉(ICA)及颈外动脉(ECA),并挂线备用。结扎CCA与ECA,夹闭ICA远心端后,迅速在ECA与ICA分叉处做切口,从切口处插入一端加热制成光滑球形的尼龙线。尼龙线进入ICA后,在入口处轻微结扎尼龙线与ICA,松开ICA的动脉夹,继续插入尼龙线至产生轻微阻力后略作回撤,使线栓插入深度达到(18.5±0.5)mm左右,实现大脑中动脉阻塞以诱导脑缺血;再次结扎入口处,尼龙线外侧预留约1cm长度,缝合皮肤。2h后轻提预留线头至产生阻力,实现大脑中动脉再灌注。该模型操作简便,缺血灶定位明确,可重复性强。
模型评价:动物苏醒后约1h,会出现神经功能缺损症状,可据此判定手术是否成功。通过TTC染色可检测到手术成功动物的脑梗死灶;常规组织切片染色可见脑缺血区的神经元、胶质细胞、血管及神经毡等出现损伤,同时伴有星形胶质细胞增生、活化及炎细胞浸润等病理改变。
4a79d37b60cb1273a993711cebf5f06a_1716287429207570.png
实验过程
1. 对SD大鼠进行称重,采用7%水合氯醛(0.5ml/100g)麻醉。用医用胶带将大鼠固定于操作台上,对颈部进行剃毛处理。
2. 用酒精棉球对颈部消毒,眼科剪沿锁骨正中做竖向切口,长度约3~4cm。
3. 分离皮下肌肉组织,可见底部肌肉下方有轻微搏动的血管,即为颈总动脉。钝性分离覆盖于颈总动脉上方的肌肉,分离出颈总动脉后,用眼科镊小心分离与其伴行的迷走神经,继续仔细分离干净动脉周围的粘膜组织,分离出的颈总动脉长度约1~1.5cm即可。
4. 小心剔除覆盖于动脉上方的粘膜组织,此时可见颈外动脉、颈内动脉与颈总动脉呈“Y”字形分布,进一步分离出独立的颈外动脉与颈内动脉。血管分离完成后,结扎颈总动脉(结扎位置越靠尾部越好)。
5. 随后结扎颈外动脉,在两个结扎点之间备线并打松结。用动脉夹暂时夹闭颈内动脉。在备线与颈总动脉结扎处之间,于离“Y”字形分叉处约0.8mm的血管正前部,用眼科剪做一“V”形切口。在血管自然状态下,用眼科镊夹持栓线,缓慢送入颈内动脉,到达动脉夹位置时,将预留的备线稍拉紧(防止远心端回流渗血),松开动脉夹,将颈总动脉稍向右牵拉后继续插入栓线,当特制栓线的黑色标记处到达“Y”字形分叉口附近时,栓线已进入大脑中动脉且无法继续前行,此时停止插入。
6. 栓线插入完成后,拉紧预留的结扎线固定栓线。用医用小棉签清理颈部血块,逐层缝合皮肤,再用酒精棉球消毒,将大鼠放回笼中。1.5h后,对大鼠再次麻醉,颈部消毒后打开一个小口,用眼科镊夹住栓线固定处,将栓线拔出至其头端,剪去多余栓线,逐层缝合切口并消毒;假手术组仅剥离颈总动脉后立即缝合创口。术后将大鼠放回笼中,提供充足的饲料与饮水。
观察指标
在MCAO动物研究中,可依据动物的生理病理特征,从运动、感觉、意识、神经反射等方面检测动物的神经功能损伤及恢复程度。神经功能学评价不仅是判断模型制备是否成功的指标,也为观察病理生理过程的发生发展、模型规范化建立及药物干预研究提供了重要依据。
1. Zea Longa法:采用5级(0~4分)评分标准。0分:无神经功能损伤;1分:提尾时对侧前肢内收屈曲(轻度神经损伤);2分:爬行时向对侧旋转(中度神经损伤);3分:站立或爬行时向对侧倾倒(重度神经损伤);4分:无自主活动且伴有意识障碍。
通常,MCAO再灌注动物模型制备成功后,动物死亡多发生在术后2d内,再灌注3d后死亡率显著降低。此外,大部分评分为3分的动物及所有4分的动物多在24h内死亡,2d内死亡率几乎达100%,主要原因是手术导致的蛛网膜下腔出血和/或脑水肿。因此,在不同再灌注时间点取材时,需排除存在蛛网膜下腔出血的动物。客观而言,缺血1h的MCAO再灌注动物模型“有效”成功率通常在60%左右,而缺血时间超过1h的模型“有效”成功率更低。因此,在MCAO再灌注动物模型中,最具研究价值的是Zea Longa评分1~2分的动物。此外,部分Zea Longa评分1分的动物,其神经缺损症状可能在1d内消失,取材后证实其梗死灶多位于纹状体区,而皮质区无梗死。
需要强调的是,术后部分大鼠可能出现缺血侧瞳孔缩小、眼裂变小等症状,即Horner征,这是由于手术中损伤颈部交感神经,导致瞳孔开大肌与睑板平滑肌(Müler肌)麻痹所致,与脑缺血本身无关,因此不能将其作为手术成功的判断指标之一。评分时需注意,1分是Zea Longa评分中2~4分的基础分,若无1分的基础表现,2~4分的评分应视为无效。
2. 改良Garcia JH评分法:从大鼠自主运动、体态对称性、前肢伸展功能、攀爬运动、身体双侧触觉、双侧胡须碰触反应等6个维度评估神经功能损伤程度,评分范围为3~18分,分值越高表示神经功能损伤越轻,18分为正常。该模型动物存在明显的学习记忆障碍,是目前较为理想的血管性痴呆(VD)模型。
应用简介
MCAO是middle cerebral artery occlusion 的缩写形式,中文意思为中脑动脉栓塞。大脑中动脉栓塞模型并不是把线栓插进大脑中动脉,而是经颈内动脉入颅并插入大脑前动脉,从而阻塞来自栓塞侧的大脑前动脉的血供,以及堵塞接受后交通动脉血供的的颈内动脉颅内段。
缺血性脑损伤常见于中老年人,具有发病率、死亡率、致残率、复发率高的特点,是目前重点防治的一种疾病。大脑中动脉(MCA)为临床上发生脑缺血损伤最常见的部位之一。故大脑中动脉阻塞(MCAO)模型被广泛用于局灶性脑缺血的研究。用血管内线栓阻断法制备大鼠MCAO模型,已被脑血管病研究者广泛接受和采用。目前实验室较多采用MCA阻断0min、90min和120min的短暂脑缺血-再灌注模型。
脑缺血模型
脑缺血模型主要通过实验动物(大鼠)来模拟人的脑部血管血流减少以及阻断的过程,以便为脑缺血的预防和治疗提供科学依据。匹配医学研究方向:脑外科、神经内科等。
实验方法:
动物分组选用健康SD雄性大鼠,体质量250至300g,所有大鼠被随机分为正常组、假手术组、模型组3组,每组9只。大鼠腹腔麻醉后固定,分离右颈总动脉(CCA)、颈内动脉(ICA)及颈(ECA)并挂线备用。结扎CCA与ECA,用动ICA远心端后,迅速在ECA与ICA分叉处作,切口处插入一端加热成光滑球形尼龙线。线ICA后,于入口处稍微结扎尼龙线与入口处ICAICA的动脉夹,继续插入尼龙线至稍有阻力后略回撤,至线插入深度为(18.5- 0.5)mm左右,实现大脑中动脉阻塞导致脑缺血,再次结扎入口处,尼龙线外留约1cm,缝合皮肤,2h后轻提所留线头至有阻力,实现大脑中动脉再灌注。此模型操作较为简单,缺血灶明确,可重复性强,同时模型评价:动物醒后约1h,即出现神经功能缺损情况,并借此判定手术成功性。TTC染色可检测手术成功的动物出现脑梗死灶。常规组织切片染色可见脑缺血区神经元、胶质细胞、血管及神经毡等损伤,以及星形胶质细胞增生、活化,炎细胞浸润等病理变化。
| 检查项目 | 表现 | 评分 | ||
| 自主运动 | 活动正常 | 3 | ||
| (观察5min大鼠在鼠笼内的活动) | 轻度影响 | 2 | ||
| 重度影响 | 1 | |||
| 无自主活动 | 0 | |||
| 体态对称性 | 体态对称 | 3 | ||
| (提起尾部使之悬空,观察四肢状态) | 体态不对称 | 2 | ||
| 偏瘫 | 1 | |||
| 前肢伸展运动 | 对称 | 3 | ||
| (提住鼠尾,将前肢移向桌面边缘,观察前爪伸展运动) | 轻度不对称 | 2 | ||
| 显著不对称 | 1 | |||
| 偏瘫 | 0 | |||
| 抓持和攀爬铁笼的能力 | 攀爬容易,抓持有力 | 3 | ||
| 一侧损害表现 | 2 | |||
| 不能攀爬或转圈 | 1 | |||
| 两侧身体触觉反射 | 双侧对称 | 3 | ||
| 一侧反应迟钝 | 2 | |||
| 一侧无反应 | 1 | |||
| 两侧胡须碰触反应 | 对称 | 3 | ||
| 不对称 | 2 | |||
| 一侧无反应 | 1 | |||
技术总结
1、整个实验很费动物,存在15-30%的淘汰率;
2、大鼠大脑中动脉永久性闭塞性脑缺血模型,梗死体积出现的最小时间点可能为2h,体积随时间进行性增大,至12h基本趋于稳定;
3、在颈内和颈外之间常常会有一个交通支,其位置也不太相同。


