
HE染色法
苏木精-伊红染色法(简称HE染色法)是目前应用最广泛的常规染色技术。其中,苏木精(hematoxylin)属于阳离子染料,可将细胞核内的嗜碱性物质染为蓝紫色;伊红(eosin)为阴离子染料,能够使细胞质、胶原纤维等成分呈现粉红色。
优质的HE切片是病理医生作出准确诊断的重要前提。作为国内外病理诊断领域普遍采用的常规染色方法,HE切片的质量直接关系到疾病诊断的及时性与准确性。
技术原理
1. 细胞核染色原理
苏木精是一种碱性天然染料,具备使细胞核着色的特性。细胞核内的染色质主要成分为DNA,其双螺旋结构中两条核苷酸链的磷酸基朝向外侧,使DNA双螺旋外侧带有负电荷,呈酸性特质,极易与带正电荷的苏木精碱性染料通过离子键或氢键结合,从而实现染色。由于苏木精在碱性溶液中呈蓝色,因此细胞核最终被染为蓝色。
2. 细胞浆染色原理
细胞浆的主要成分是蛋白质,而蛋白质属于两性化合物,因此细胞浆的染色效果与环境pH值密切相关。当pH值调节至蛋白质等电点(4.7-5.0)时,细胞浆对外不显电性,此时酸性或碱性染料均难以使其染色;若pH值调至6.7-6.8(高于蛋白质等电点),细胞浆会发生酸性电离并带有负电荷,可与带正电荷的染料结合染色,但此时细胞核也会被染色,导致核与浆难以区分。
因此,需将pH值调节至细胞浆等电点以下,通过在染液中添加醋酸使细胞浆带正电荷(阳离子),进而与带负电荷(阴离子)的染料结合染色。伊红Y是人工合成的酸性染料,在水中可离解为带负电荷的阴离子,该阴离子能与蛋白质的氨基正电荷(阳离子)结合,使细胞浆着色。最终,细胞浆、红细胞、肌肉组织、结缔组织、嗜伊红颗粒等成分会被染成不同深浅的红色或粉红色,与蓝色的细胞核形成鲜明对比。
3. 分化作用
染色完成后,使用特定溶液去除组织上过多结合的染色剂,这一过程称为分化,所用溶液即为分化液。HE染色中常用0.5%盐酸乙醇作为分化液,其原理是酸能破坏苏木精的醌型结构,使组织与色素分离并褪色。经苏木精染色后,必须通过0.5%盐酸乙醇进行分化,去除细胞核上过量结合的苏木精染料以及细胞浆吸附的苏木精染料,再进行伊红染色,才能确保细胞核与细胞浆染色界限清晰。因此,分化是HE染色中至关重要的环节。
4. 返蓝作用
分化后,苏木精在酸性条件下呈红色离子状态,表现为红色;在碱性条件下则呈蓝色离子状态,表现为蓝色。组织切片经0.5%盐酸乙醇分化后,会呈现红色或粉红色。因此,分化结束后,需立即用水冲洗组织切片以去除酸性物质,终止分化过程,再用弱碱性水(0.2%氨水)处理,使经苏木精染色的细胞核呈现蓝色,这一过程称为返蓝作用(又称蓝化作用)。此外,也可通过自来水浸洗实现细胞核返蓝,但所需时间相对更长。
实验步骤

实验结果展示
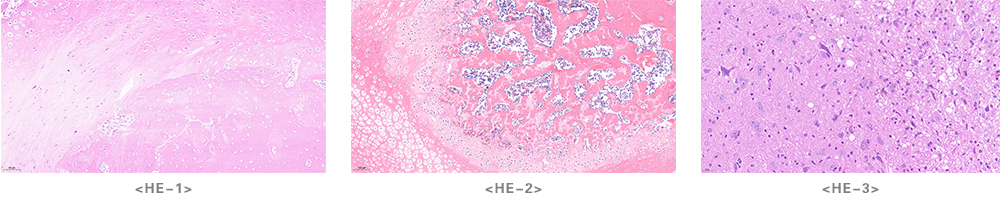
注意事项
1. pH值控制
若组织块在福尔马林中固定时间过长,会导致组织酸化,影响细胞核着色效果。针对这一情况,可延长组织块在自来水中的冲洗时间,或在饱和碳酸锂水溶液中处理10-30分钟,以确保细胞核着色更深。若伊红染色时细胞浆着色效果不佳,可在伊红溶液中滴加1-2滴冰醋酸进行调整。
2. 分色时间把控
分色是HE染色的关键步骤,需在显微镜下实时观察控制,理想状态为细胞核染色清晰、细胞质基本无色。若分色时间过长,会导致染色过浅,此时需重新染色后再进行分色操作。
3. 酒精脱水要求
酒精脱水必须彻底。若切片经酒精脱水后进入二甲苯时出现白色不透明现象,说明脱水不彻底,需将切片退回无水酒精中,更换酒精和二甲苯后重新处理,确保脱水与透明完全。此外,切片从二甲苯中取出或进入二甲苯前,需擦拭干净或吸干切片周边的多余水分。
4. 避免切片干燥
染色过程中需确保切片始终处于湿润状态,避免干燥。若切片干燥,会发生收缩、变形,影响神经元形态,进而干扰观察结果。
5. 避免切片污染
切片污染会导致污染物遮盖部分细胞或组织,影响其形态观察。因此,需定期过滤各类染液和试剂,以清除其中的沉淀物,避免污染产生。
6. 避免脱蜡不完全
冬季室温较低(14℃以下)时,需将二甲苯置于水浴锅中加温至30℃左右再进行脱蜡操作,以防止因脱蜡不完全导致染色不均匀、出现雾化现象。
7. 封片注意事项
最终封固时,需使用中性树脂,以防止切片日后褪色;盖片需选用面积大于组织块的规格,若组织块部分裸露,不久后会发生褪色;所用树脂浓度需适宜,封固过程中需避免产生气泡。
送样运输要求
1. 样本需置于20倍样本体积的固定液中固定24小时以上,采用常温运输送样。
2. 严禁固定时间过长,同时避免样本冷冻结冰。


