
技术原理
免疫组化,是应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及定量的研究,称为免疫组织化学技术(immunohistochemistry)或免疫细胞化学技术(immunocytochemistry)。
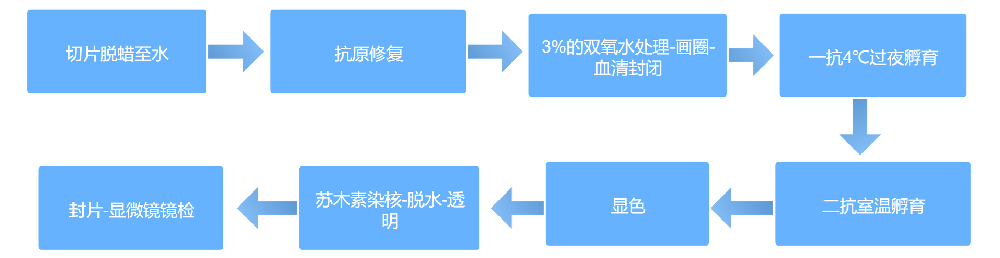
实验步骤
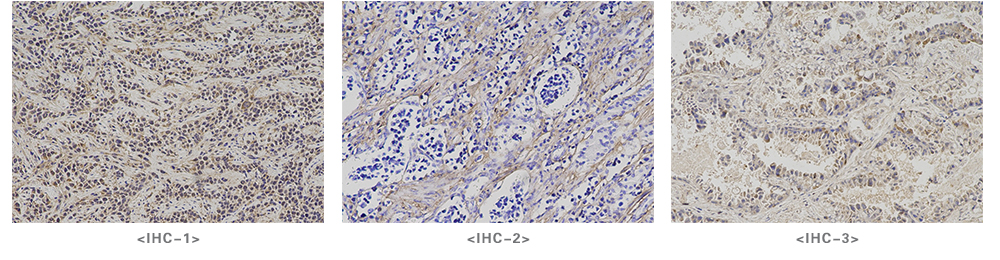
实验结果展示:
送样运输要求
石蜡切片制片:组织取样后需立即放入固定液,禁止对组织进行冻存处理。
冰冻切片制片:需选用新鲜组织进行制备,防止因组织放置过久出现抗原丢失。
标本保存期限:组织蜡块可长期保存;石蜡切片的保存时间理论上不宜超过半年,冰冻切片的保存时间则不应超过 3 个月。
注意事项
苏木素复染的时长需根据实验实际情况摸索确定,尤其是当目标阳性染色位点同样位于细胞核时,更需精准把控复染时间。
DAB 显色操作需实现时长最优化,应在显微镜下实时观察显色进度,以阳性染色清晰可辨且背景着色较浅为最佳状态。
抗体孵育的时间与抗体浓度参数需通过预实验摸索调整;其中一抗孵育建议采用 4℃条件下过夜孵育的方式,以提升抗原抗体结合效率。
切片的脱蜡与水化步骤必须充分彻底;添加各类反应液时,需确保液体完全覆盖组织样本;每次更换液体前,需将切片上的洗涤液甩干,但要避免切片出现干燥现象;使用组化笔圈定组织范围时,圈定面积应尽量大一些,防止墨水排斥反应导致切片边缘出现干片。
常见问题
片子着色不均匀?
脱蜡不充分:可将切片置于 60℃烤箱烘烤 20 min,随后立即放入新鲜二甲苯 Ⅰ 中进行脱蜡。
水化不全:需定期配制新鲜的梯度乙醇溶液,保障水化效果。
抗体未混匀:使用移液器将一抗、二抗等试剂充分吹打混匀后再进行孵育。
抗体孵育时切片放置倾斜,导致液体分布不均。
抗体孵育后 PBS 冲洗不充分,残留试剂影响染色均匀度。
制片厚薄不均,或染片盒放置不平整、切片倾斜,造成染色效果差异。
一抗从 4℃拿出后,为什么有人说要 37℃复温,目的是什么?一方面,可避免切片从 4℃低温环境直接放入 PBS 溶液中,减少脱片现象的发生;另一方面,能够促使抗原抗体结合更稳定。该操作并非必需步骤,但对于表达量较低的抗原可能有一定帮助。4℃与 37℃条件下分子运动存在差异,低温环境下分子碰撞概率与运动速度更低,37℃复温可加快抗原抗体结合速度,提升检测敏感性,但同时也可能增加非特异性染色的风险。
切片染色后背景太深,不易区分特异性与非特异性着色?
抗体孵育时间过长或抗体浓度过高,可通过缩短一抗、二抗孵育时间,以及适当稀释抗体浓度来改善。
若一抗使用多克隆抗体,易出现非特异性着色,建议更换为单克隆抗体尝试。
肝脏、肾脏等组织中内源性过氧化物酶与生物素含量较高,需通过延长灭活时间、提高灭活剂浓度的方式降低背景染色。
非特异性组分与抗体发生结合,可延长二抗来源动物的免疫血清封闭时间,并适当提高血清浓度,增强封闭效果。
DAB 显色时间过长或显色液浓度过高,需严格把控显色时长与试剂浓度。
PBS 冲洗不充分,残留抗体持续反应导致着色增强,需增加冲洗次数与时长。
标本染色过程中出现干片,极易引发非特异性着色,操作中需全程避免切片干燥。


