
尼氏染色
尼氏染色技术由德国科学家 Franz Nissl 于 1892 年创立,该方法也因发明人而得名。细胞内的 DNA 与 RNA 均呈酸性且带负电荷,这一特性源于二者分别由脱氧核糖核苷酸和核糖核苷酸构成。以脱氧核糖核苷酸为例,其分子结构包含碱基、脱氧核糖与磷酸基团,其中磷酸基团是赋予 DNA 和 RNA 负电属性的关键。尼氏染色正是利用这一酸碱结合原理,采用甲酚紫、甲苯胺蓝等碱性染料对 DNA 和 RNA 进行特异性结合,从而实现细胞的着色标记。
该染色方法的靶向位点主要集中在 DNA 高度聚集的细胞核,以及富含 RNA 的内质网,尤其是粗面内质网。粗面内质网上附着的核糖体含有核糖体 RNA,其含量占细胞 RNA 总量的 80% 以上,也正因粗面内质网是尼氏染色的典型阳性区域,该结构又被称为尼氏体。
技术原理
神经元细胞体的结构特征显著,包含核膜皱褶明显的大细胞核、分布稀疏的染色质,以及形态清晰的核仁。细胞体的细胞质中存在嗜碱性颗粒,即尼氏颗粒,这类颗粒本质为粗面内质网,在多数神经元中呈现特异性斑点状嗜碱性表现。
尼氏颗粒可通过多种染料进行染色标记,常见染料包括中性红、亚甲基蓝、甲苯胺蓝及甲基紫等。染色效果会受染色条件影响,染料配方、染液 pH 值及分化时间的差异,既可以使染色仅突出显示尼氏物质,也能够同时呈现神经元细胞核与神经胶质细胞的形态。
尼氏体广泛存在于各类神经细胞内,但不同细胞中尼氏体的形态、数量及分布位置存在明显差异。从分布范围来看,尼氏体可见于神经元的树突,却不存在于轴突及胞体的轴丘部位。
尼氏体的形态与数量会随神经元生理状态发生动态变化。作为神经元内蛋白质合成的核心场所,当神经元受到外界刺激时,胞体内的尼氏体数量会出现显著减少。在染色表现上,尼氏体可被硫堇、亚甲蓝、甲苯胺蓝、焦油紫等碱性染料染成特征性紫蓝色。
实验流程
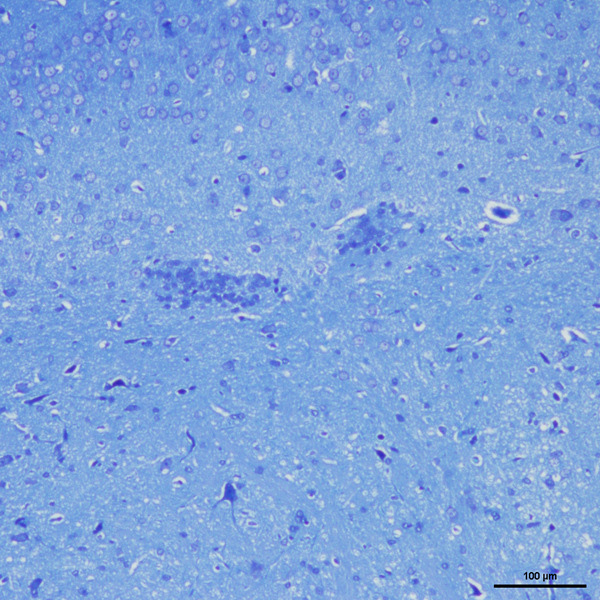
实验结果展示
注意事项
若实验所用切片为石蜡切片,需先置于二甲苯溶液中完成脱蜡处理,再进行后续染色步骤。
焦油紫或硫堇的染色时间需灵活调整,具体时长取决于染液配制时间、切片厚度及实验环境温度。
染色后的分色程度需在显微镜下实时观察,理想状态为尼氏小体呈深色,背景基本无色。若分色不足,可将切片退回酒精溶液再次分色;若分色过度,也可重新进行染色操作。
尼氏染色完成后需进行充分脱水,否则染色结果易出现褪色现象。
尽管 HE 染色也能观察到胞质中的嗜碱性颗粒,但该方法显示的结构清晰度不足,难以准确区分神经元的轴突与树突。相比之下,尼氏染色可清晰呈现尼氏体形态,便于轴突和树突的辨别。染色后的尼氏体多呈块状(类似虎斑)或颗粒状,核周区域的尼氏体颗粒体积较大,靠近细胞边缘的颗粒则细小且形态细长。在生理状态下,尼氏体体积大、数量多,提示神经元的蛋白质合成功能较强;当神经元受损时,尼氏体的数量会减少甚至完全消失。


